铁死亡相关的 lncRNA 对预测胰腺导管腺癌(PDAC)的临床结果和分子特征
发布日期:2023-08-16 浏览次数:1751
Ferroptosis-related lncRNA pairs to predict the clinical outcome and molecular characteristics of pancreatic ductal adenocarcinoma.
铁死亡相关的 lncRNA 对预测胰腺导管腺癌(PDAC)的临床结果和分子特征
本研究的首要目标是使用生物信息学方法结合实验验证来鉴定铁死亡相关的 lncRNA;
第二个目标是构建一个预后模型来预测 PDAC 患者的总生存期。

研究背景:
最新数据显示,胰腺癌患者的 5 年生存率约为 9%。胰腺导管腺癌(PDAC)是胰腺癌最常见的病理分类,其特点是对化疗高度不敏感,预后不佳。铁死亡(Ferroptosis)是一种由氧化扰动引发的受调节细胞死亡形式,可被铁螯合剂和亲脂性抗氧化剂阻断 。值得注意的是,铁死亡诱导剂可能是治疗多种化疗耐药肿瘤的有效武器 ,尤其是 PDAC 。鉴于临床实践中胰腺癌治疗的有效药物极度缺乏,迫切需要新的药物靶点。因此,作为一种可靶向且有效的肿瘤杀伤过程,铁死亡被认为是胰腺癌的“终点“。然而,铁死亡在 PDAC 等癌症中的调节机制和临床相关性仍不清楚,需要进一步研究。
以往的研究主要集中在蛋白质编码基因(mRNA)在铁死亡过程中的作用,并确定了一系列决定铁死亡敏感性的基因,例如谷胱甘肽过氧化物酶 4 (GPX4) 、溶质载体家族 7 成员 11 (SLC7A11) 和酰基辅酶 A 合成酶长链家族成员 4 (ACSL4) 。大量研究已经注意到长链非编码RNAs (lncRNAs)通过与DNA、RNA和蛋白质结合来调节癌细胞的生物学行为。然而,很少有研究报道lncRNAs在铁死亡过程中的作用以及铁死亡相关的功能 lncRNA。
因此,铁死亡相关 lncRNA(FRL)的鉴定对于破译 PDAC 肿瘤发生的潜在机制和研究新的治疗靶点具有重要意义。
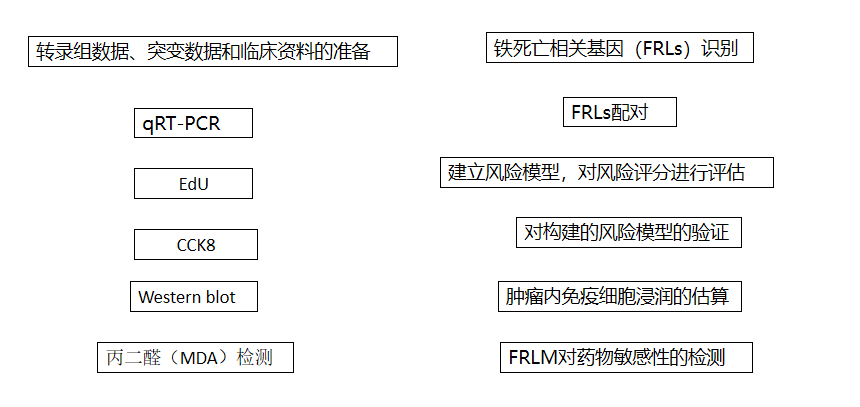
主要设计流程
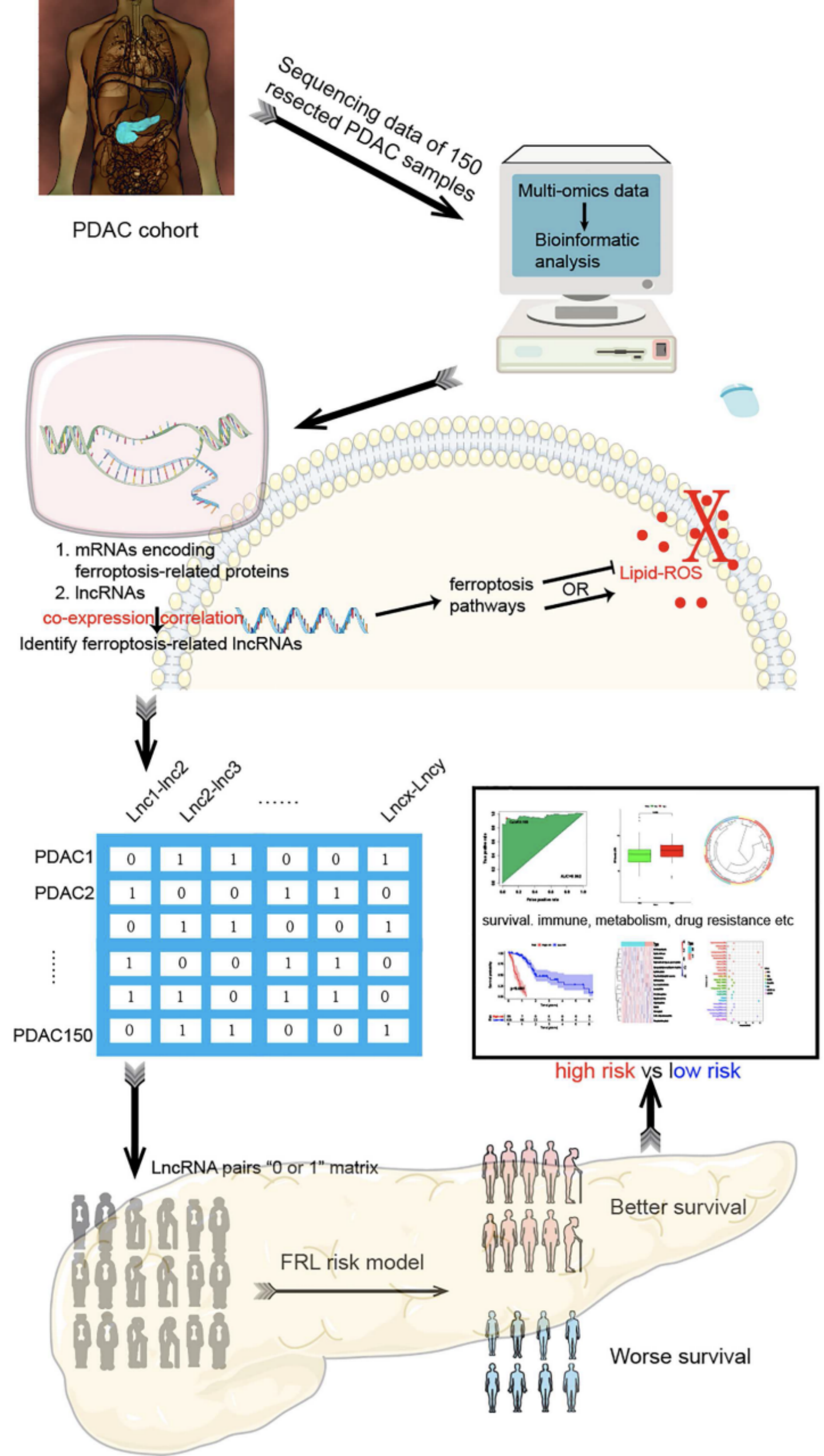
从TCGA中提取150对切除的PDACs中265个铁死亡调节基因(FRG)和14806个lncRNA的转录组表达水平,然后整合到共表达矩阵中。根据筛选标准(r>0.5 and P<0.0001),筛选出786个FRLs。132个FRLs在癌组织和正常组织中有差异表达。
根据FRLs表达的0或1矩阵构建预后模型,通过预后模型计算出的两个具有不同风险评分的人群:high risk&low risk
模型验证
模型功能研究
1.使用生物信息学方法和实验验证识别FRLs
在胰腺癌细胞系中鉴定了与铁死亡相关的lncRNA (FRLs),并验证了lncRNA SLCO4A1-AS1是潜在的铁死亡负调控因子

部分lncRNA 与三种核心铁死亡调控因子ACSL4、SLC7A11和GPX4的表达高度相关(图2A)
在FUSCC队列的105对胰腺癌和癌旁以及E-MTAB-6134队列的 288个胰腺癌样本中分析了SLCO4A1的表达。结果显示SLCO4A1-AS1表达在肿瘤组织中显著上调(图2B),并与SLC7A11表达正相关。
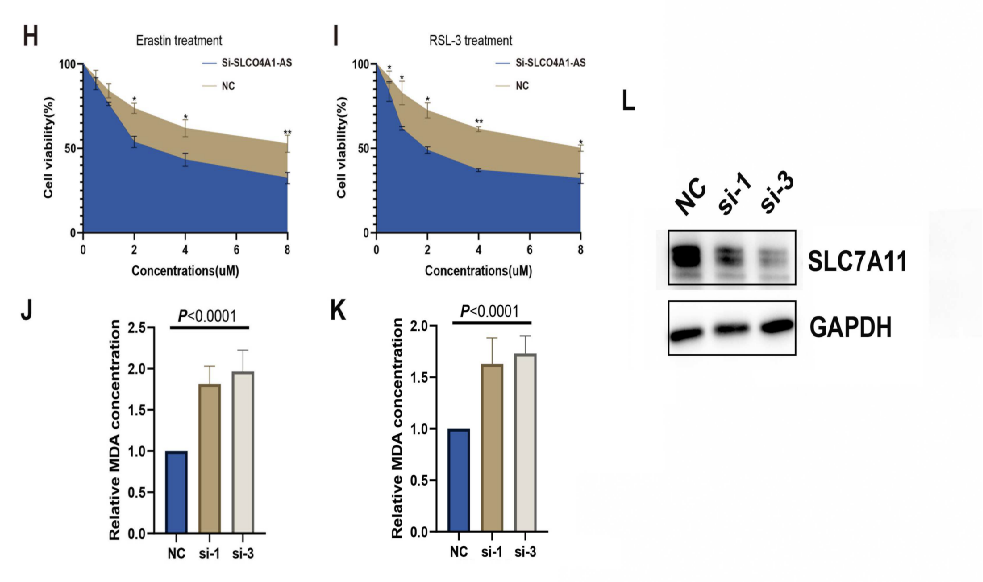
然后在六种常见胰腺癌细胞系中评估SLCO4A1-AS1的表达(图2E)。而在Panc-1细胞中SLCO4A1-AS表达最高(图2F)。然后在Panc-1细胞中下调SLCO4A1-AS1的表达,Panc-1癌细胞的增殖没有明显影响(图2G)。
考虑到SLCO4A1-AS1的表达与SLC7A11的表达呈正相关,评估SLCO4A1-AS1表达的降低是否影响铁死亡的敏感性。结果显示,lncRNA SLCO4A1-AS1基因敲低显著上调了胰腺癌细胞对erastin和RSL-3诱导的铁死亡的敏感性,这表明lncRNA SLCO4A1-AS1可能是介导铁死亡抗性的新分子(图2H和I)。lncRNA SLCO4A1-AS1的降低显著上调了MDA浓度(图2J和K)。通过western blot检测了erastin靶点SLC7A11的表达水平。发现当敲除SLCO4A1-AS1时,SLC7A11的表达显著降低(图2L)。
2.构建预测PDAC患者OS的FRL模型(FRLM)
重新排列132个FRLs的转录组表达矩阵以构建由4715个 lncRNA对组成的0或1矩阵。通过单因素Cox回归以筛选OS相关的lncRNA,Lasso回归计算FRLM中每个lncRNA对的系数。最终,14对lncRNA用于构建模型。
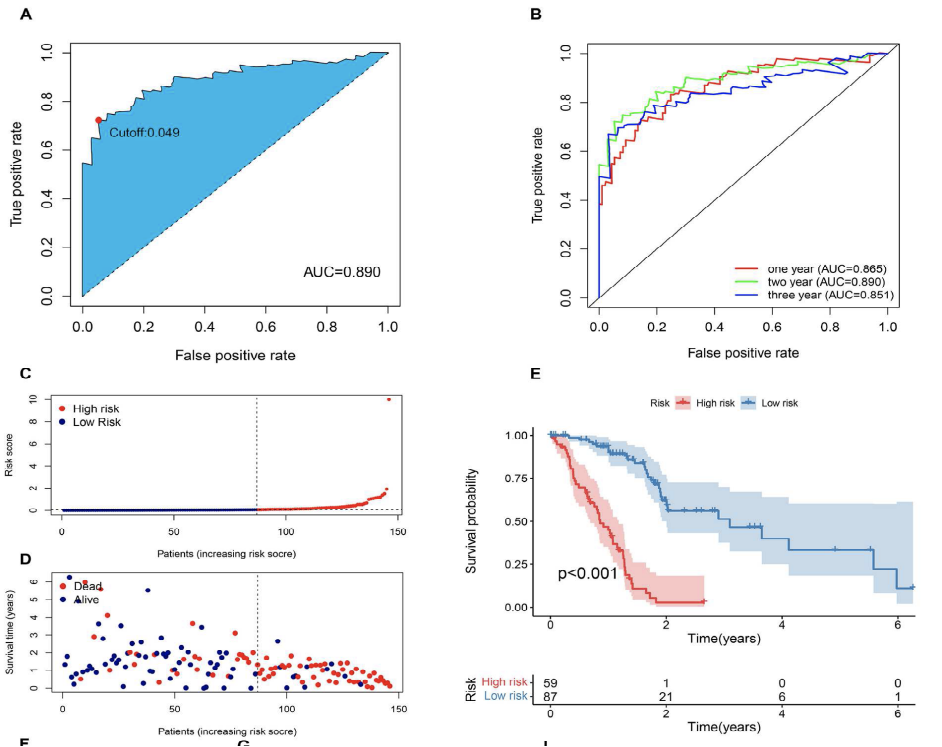
根据线性FRLM风险评分,绘制ROC曲线,评估患者OS的预测准确性。最优临界值定义为反映最大AUC值的风险评分(图3A和B)。
根据模型最佳临界值将患者分为两组(图3C)。在高危组中观察到更多的死亡事件,提示PDAC患者FRLM风险的增加反映了不良预后(图3D)。Kaplan Meier曲线显示,在FRLM风险较高的患者中,生存时间几乎降低了2倍, Figure 3E)。
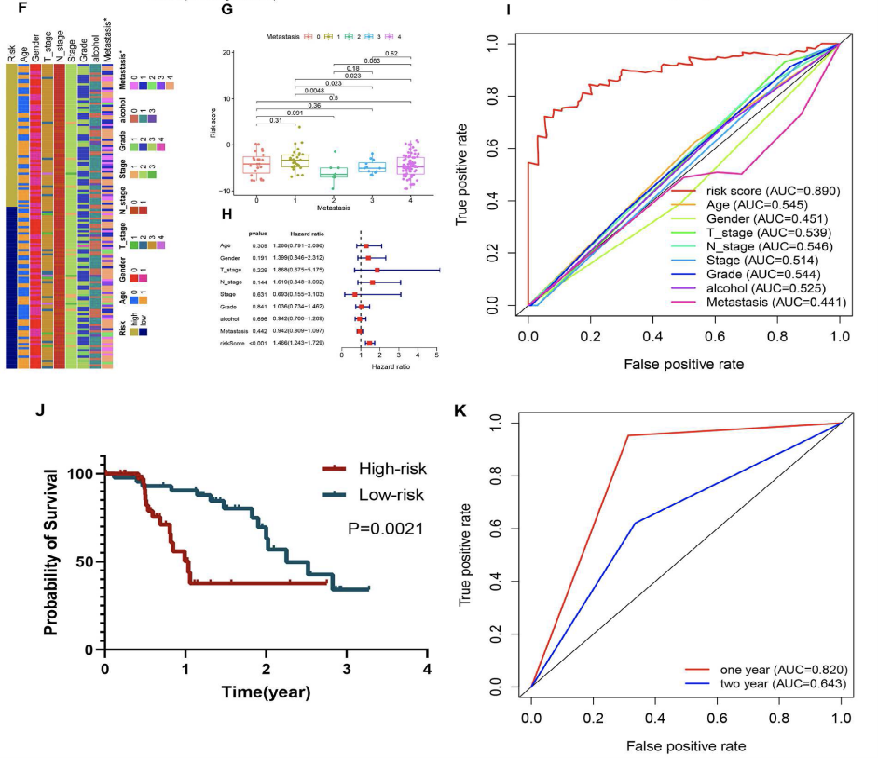
模型风险组之间的年龄、性别、T分期、N分期、AJCC分期、等级和酒精史具有可比性,但在高危患者中发现更多的肝转移,而不是肺部或其他部位的转移(图3F和G)。这些传统临床参数的预测能力明显弱于构建铁死亡lncRNA模型风险评分(图3H)。多变量Cox 回归也表明铁死亡相关lncRNA是胰腺癌患者总体生存的独立预测因素(图 3I)。
FUSCC队列来验证FRLM的有效性。KM结果显示,FRLM可以区分不同预后的患者(图3J)。FRLM在FUSCC中1年和2年的AUC分别为0.82和0.64(图3K)。
3.FRLM差异表达基因揭示了PDAC中FRLM风险相关的代谢机制

在FRLM高风险组和低风险组之间共鉴定出726个差异表达基因(图4A)。
KEGG富集分析表明,这些基因参与代谢途径,例如癌症中的蛋白聚糖、果糖和甘露糖代谢、糖酵解/糖异生和 N-聚糖生物合成(图4B)。
因此,进一步检测了PDAC样本中与FRLM风险相关的代谢重组。共识别出12条不同激活的代谢通路,包括5条在FRLM低风险组上调的通路,例如牛磺酸和次牛磺酸代谢,以及7条在FRLM高危组上调通路,如嘧啶代谢(图4C)。
此外,还检测了FRLM高危组不同激活的代谢途径之间的相关性,结果表明,这些途径,包括氨基酸代谢、糖代谢、脂代谢和核苷酸代谢,在该亚型中高度相关,揭示了重组代谢网络中的相互作用(图4D)。
4.FRLM高危组和低危组免疫微环境和免疫相关特征的差异
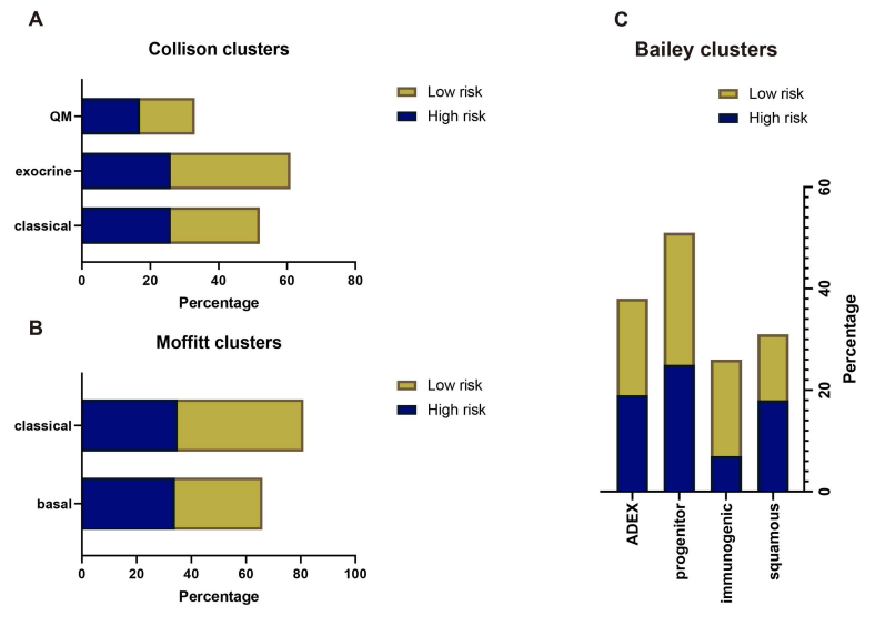
比较了先前报道的两组PDAC亚型的构成。结果显示,PDAC各亚型的百分比与基于FRLM的聚类一致(P>0.05,Figure 5A–C),这表明FRLM产生了一个独立的分类。
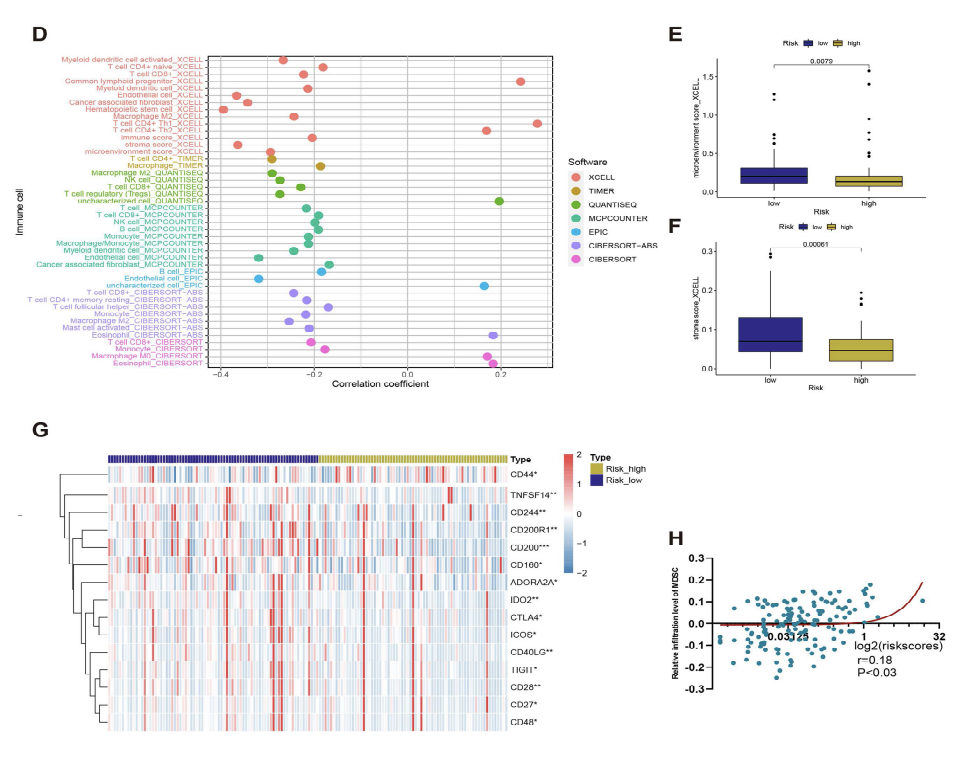
研究了FRLM风险与免疫细胞浸润之间的相关性,发现FRLM风险与基质和微环境评分呈负相关,这表明FRLM风险增加与肿瘤内浸润的基质细胞(图5E和F)减少有关。FRLM风险还与多种抗肿瘤免疫成分的浸润呈负相关,包括CD8+T细胞、NK细胞和活化的树突细胞( 图5D)
进一步研究了FRLM风险评分与免疫检查点基因表达水平的关系。CTLA4( 临床批准药物的靶点) 在FRLM低风险组中上调 (图5G)。相比之下,浸润的 CD8+T细胞数量随着风险评分的增加而减少,这表明低风险样本含有相对丰富的 CD8+T细胞,但抑制性受体(如CTLA4)的过度表达抑制了CD8+T细胞的细胞毒功能。髓源性抑制细胞浸润增多与FRLM风险评分呈正相关,进一步揭示了FRLM风险评分较高的pdac中存在免疫抑制微环境(图5H)。
5.比较不同FRLM风险评分的PDAC中铁死亡调节因子的差异表达
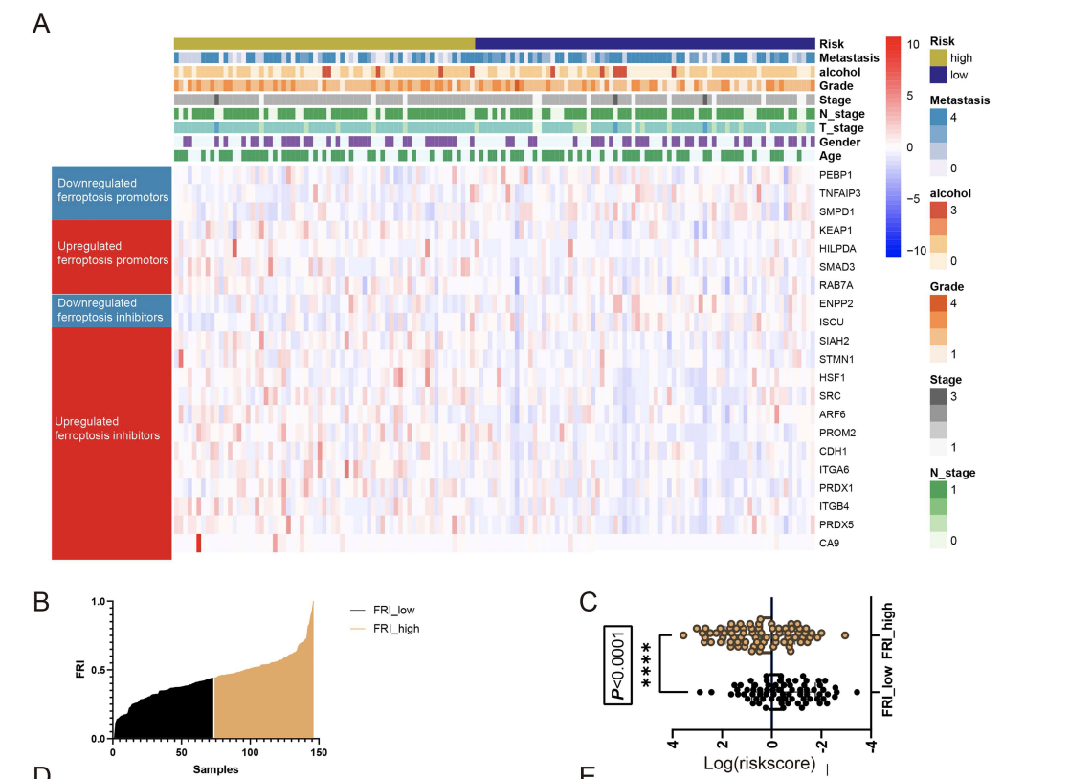
比较FRLM高和低风险评分的PDACs中铁死亡调控因子的表达模式。在FRLM高风险组中,共有12个抗铁死亡调控子上调,在FRLM低风险组中有3个铁死亡启动子上调(图6A)。
进一步计算每个样本的铁死亡抵抗指数(FRI),将样本分为高FRI组和低FRI组(图6B)。值得注意的是,FRLM风险在FRI高组显著增加(P<0.0001)(图6C)。
这表明FRLM风险评分高的患者对铁死亡内在抵抗可能导致了不良结果
6.PDAC样本中FRLM风险相关突变情况
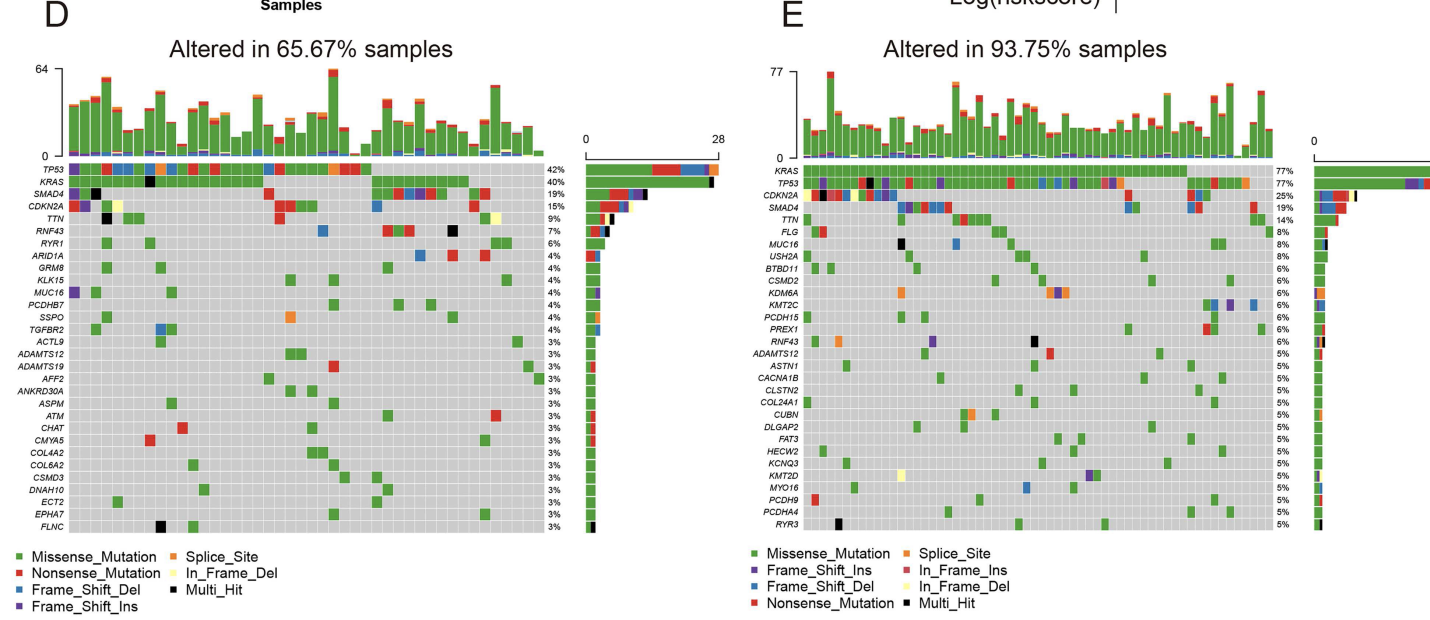
比较了FRLM高风险和低风险组的突变情况。结果表明,风险较高的样本中发生了更多的突变事件,其中KRAS突变是这些样本中的主要变化(图6E)。相比之下,风险较低的组中,前30个改变基因的突变率明显降低(图6D)。
7.不同FRLM风险评分患者对抗癌药物敏感性的比较
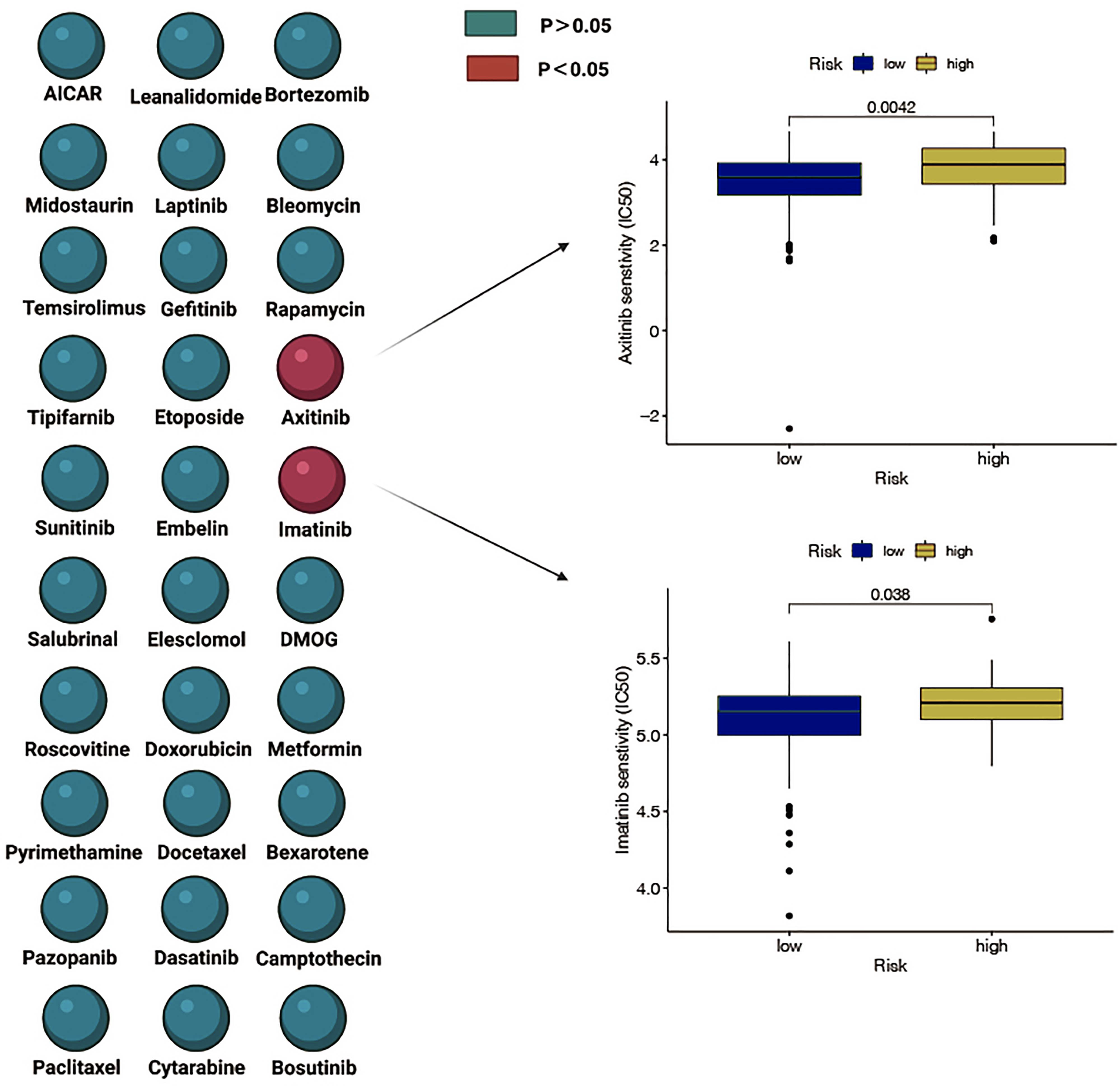
比较了高危组和低危组对30种常见抗癌药物的敏感性,以确定潜在的胰腺癌治疗模式。
研究表明,两种食品和药物管理局(FDA)批准的抗肿瘤药物伊马替尼和阿西替尼的IC50在FRLM风险较高的患者中更高,这表明FRLM风险的降低伴随着对伊马替尼和阿西替尼敏感性的增加。在此背景下,这些药物有潜力在未来应用于FRLM风险低的胰腺癌的治疗。
总结
这篇文献的亮点在于首先筛选了 FRLs,并且实验验证了 SLCO4A1-AS1 作为胰腺导管腺癌中的新型铁死亡抑制剂;其次基于胰腺癌大群体队列中FRLs表达的0或1矩阵构建了预后模型,该模型显示出较高的诊断准确性,并证明与免疫微环境、代谢重编程、抗铁死亡、突变景观和药物敏感性有关,这可以指导后续的临床决策。
方法
Ferroptosis-related lncRNA pairs to predict the clinical outcome and molecular characteristics of pancreatic ductal adenocarcinoma.
铁死亡相关的 lncRNA 对预测胰腺导管腺癌(PDAC)的临床结果和分子特征
本研究的首要目标是使用生物信息学方法结合实验验证来鉴定铁死亡相关的 lncRNA;
第二个目标是构建一个预后模型来预测 PDAC 患者的总生存期。

研究背景:
最新数据显示,胰腺癌患者的 5 年生存率约为 9%。胰腺导管腺癌(PDAC)是胰腺癌最常见的病理分类,其特点是对化疗高度不敏感,预后不佳。铁死亡(Ferroptosis)是一种由氧化扰动引发的受调节细胞死亡形式,可被铁螯合剂和亲脂性抗氧化剂阻断 。值得注意的是,铁死亡诱导剂可能是治疗多种化疗耐药肿瘤的有效武器 ,尤其是 PDAC 。鉴于临床实践中胰腺癌治疗的有效药物极度缺乏,迫切需要新的药物靶点。因此,作为一种可靶向且有效的肿瘤杀伤过程,铁死亡被认为是胰腺癌的“终点“。然而,铁死亡在 PDAC 等癌症中的调节机制和临床相关性仍不清楚,需要进一步研究。
以往的研究主要集中在蛋白质编码基因(mRNA)在铁死亡过程中的作用,并确定了一系列决定铁死亡敏感性的基因,例如谷胱甘肽过氧化物酶 4 (GPX4) 、溶质载体家族 7 成员 11 (SLC7A11) 和酰基辅酶 A 合成酶长链家族成员 4 (ACSL4) 。大量研究已经注意到长链非编码RNAs (lncRNAs)通过与DNA、RNA和蛋白质结合来调节癌细胞的生物学行为。然而,很少有研究报道lncRNAs在铁死亡过程中的作用以及铁死亡相关的功能 lncRNA。
因此,铁死亡相关 lncRNA(FRL)的鉴定对于破译 PDAC 肿瘤发生的潜在机制和研究新的治疗靶点具有重要意义。
主要设计流程

从TCGA中提取150对切除的PDACs中265个铁死亡调节基因(FRG)和14806个lncRNA的转录组表达水平,然后整合到共表达矩阵中。根据筛选标准(r>0.5 and P<0.0001),筛选出786个FRLs。132个FRLs在癌组织和正常组织中有差异表达。
根据FRLs表达的0或1矩阵构建预后模型,通过预后模型计算出的两个具有不同风险评分的人群:high risk&low risk
模型验证
模型功能研究
1.使用生物信息学方法和实验验证识别FRLs
在胰腺癌细胞系中鉴定了与铁死亡相关的lncRNA (FRLs),并验证了lncRNA SLCO4A1-AS1是潜在的铁死亡负调控因子


部分lncRNA 与三种核心铁死亡调控因子ACSL4、SLC7A11和GPX4的表达高度相关(图2A)
在FUSCC队列的105对胰腺癌和癌旁以及E-MTAB-6134队列的 288个胰腺癌样本中分析了SLCO4A1的表达。结果显示SLCO4A1-AS1表达在肿瘤组织中显著上调(图2B),并与SLC7A11表达正相关。
然后在六种常见胰腺癌细胞系中评估SLCO4A1-AS1的表达(图2E)。而在Panc-1细胞中SLCO4A1-AS表达最高(图2F)。然后在Panc-1细胞中下调SLCO4A1-AS1的表达,Panc-1癌细胞的增殖没有明显影响(图2G)。
考虑到SLCO4A1-AS1的表达与SLC7A11的表达呈正相关,评估SLCO4A1-AS1表达的降低是否影响铁死亡的敏感性。结果显示,lncRNA SLCO4A1-AS1基因敲低显著上调了胰腺癌细胞对erastin和RSL-3诱导的铁死亡的敏感性,这表明lncRNA SLCO4A1-AS1可能是介导铁死亡抗性的新分子(图2H和I)。lncRNA SLCO4A1-AS1的降低显著上调了MDA浓度(图2J和K)。通过western blot检测了erastin靶点SLC7A11的表达水平。发现当敲除SLCO4A1-AS1时,SLC7A11的表达显著降低(图2L)。
2.构建预测PDAC患者OS的FRL模型(FRLM)


重新排列132个FRLs的转录组表达矩阵以构建由4715个 lncRNA对组成的0或1矩阵。通过单因素Cox回归以筛选OS相关的lncRNA,Lasso回归计算FRLM中每个lncRNA对的系数。最终,14对lncRNA用于构建模型。
根据线性FRLM风险评分,绘制ROC曲线,评估患者OS的预测准确性。最优临界值定义为反映最大AUC值的风险评分(图3A和B)。
根据模型最佳临界值将患者分为两组(图3C)。在高危组中观察到更多的死亡事件,提示PDAC患者FRLM风险的增加反映了不良预后(图3D)。Kaplan Meier曲线显示,在FRLM风险较高的患者中,生存时间几乎降低了2倍, Figure 3E)。
模型风险组之间的年龄、性别、T分期、N分期、AJCC分期、等级和酒精史具有可比性,但在高危患者中发现更多的肝转移,而不是肺部或其他部位的转移(图3F和G)。这些传统临床参数的预测能力明显弱于构建铁死亡lncRNA模型风险评分(图3H)。多变量Cox 回归也表明铁死亡相关lncRNA是胰腺癌患者总体生存的独立预测因素(图 3I)。
FUSCC队列来验证FRLM的有效性。KM结果显示,FRLM可以区分不同预后的患者(图3J)。FRLM在FUSCC中1年和2年的AUC分别为0.82和0.64(图3K)。
3.FRLM差异表达基因揭示了PDAC中FRLM风险相关的代谢机制

在FRLM高风险组和低风险组之间共鉴定出726个差异表达基因(图4A)。
KEGG富集分析表明,这些基因参与代谢途径,例如癌症中的蛋白聚糖、果糖和甘露糖代谢、糖酵解/糖异生和 N-聚糖生物合成(图4B)。
因此,进一步检测了PDAC样本中与FRLM风险相关的代谢重组。共识别出12条不同激活的代谢通路,包括5条在FRLM低风险组上调的通路,例如牛磺酸和次牛磺酸代谢,以及7条在FRLM高危组上调通路,如嘧啶代谢(图4C)。
此外,还检测了FRLM高危组不同激活的代谢途径之间的相关性,结果表明,这些途径,包括氨基酸代谢、糖代谢、脂代谢和核苷酸代谢,在该亚型中高度相关,揭示了重组代谢网络中的相互作用(图4D)。
4.FRLM高危组和低危组免疫微环境和免疫相关特征的差异


比较了先前报道的两组PDAC亚型的构成。结果显示,PDAC各亚型的百分比与基于FRLM的聚类一致(P>0.05,Figure 5A–C),这表明FRLM产生了一个独立的分类。
研究了FRLM风险与免疫细胞浸润之间的相关性,发现FRLM风险与基质和微环境评分呈负相关,这表明FRLM风险增加与肿瘤内浸润的基质细胞(图5E和F)减少有关。FRLM风险还与多种抗肿瘤免疫成分的浸润呈负相关,包括CD8+T细胞、NK细胞和活化的树突细胞( 图5D)
进一步研究了FRLM风险评分与免疫检查点基因表达水平的关系。CTLA4( 临床批准药物的靶点) 在FRLM低风险组中上调 (图5G)。相比之下,浸润的 CD8+T细胞数量随着风险评分的增加而减少,这表明低风险样本含有相对丰富的 CD8+T细胞,但抑制性受体(如CTLA4)的过度表达抑制了CD8+T细胞的细胞毒功能。髓源性抑制细胞浸润增多与FRLM风险评分呈正相关,进一步揭示了FRLM风险评分较高的pdac中存在免疫抑制微环境(图5H)。
5.比较不同FRLM风险评分的PDAC中铁死亡调节因子的差异表达

比较FRLM高和低风险评分的PDACs中铁死亡调控因子的表达模式。在FRLM高风险组中,共有12个抗铁死亡调控子上调,在FRLM低风险组中有3个铁死亡启动子上调(图6A)。
进一步计算每个样本的铁死亡抵抗指数(FRI),将样本分为高FRI组和低FRI组(图6B)。值得注意的是,FRLM风险在FRI高组显著增加(P<0.0001)(图6C)。
这表明FRLM风险评分高的患者对铁死亡内在抵抗可能导致了不良结果
6.PDAC样本中FRLM风险相关突变情况

比较了FRLM高风险和低风险组的突变情况。结果表明,风险较高的样本中发生了更多的突变事件,其中KRAS突变是这些样本中的主要变化(图6E)。相比之下,风险较低的组中,前30个改变基因的突变率明显降低(图6D)。
7.不同FRLM风险评分患者对抗癌药物敏感性的比较

比较了高危组和低危组对30种常见抗癌药物的敏感性,以确定潜在的胰腺癌治疗模式。
研究表明,两种食品和药物管理局(FDA)批准的抗肿瘤药物伊马替尼和阿西替尼的IC50在FRLM风险较高的患者中更高,这表明FRLM风险的降低伴随着对伊马替尼和阿西替尼敏感性的增加。在此背景下,这些药物有潜力在未来应用于FRLM风险低的胰腺癌的治疗。
总结
这篇文献的亮点在于首先筛选了 FRLs,并且实验验证了 SLCO4A1-AS1 作为胰腺导管腺癌中的新型铁死亡抑制剂;其次基于胰腺癌大群体队列中FRLs表达的0或1矩阵构建了预后模型,该模型显示出较高的诊断准确性,并证明与免疫微环境、代谢重编程、抗铁死亡、突变景观和药物敏感性有关,这可以指导后续的临床决策。
方法




