巨噬细胞分型与肿瘤微环境
发布日期:2023-08-09 浏览次数:1453
文献案例
英文标题:Colorectal Cancer-Derived Small Extracellular Vesicles Promote Tumor Immune Evasion by Upregulating PD-L1 Expression in Tumor-Associated Macrophages
期刊:Advanced Science
发表时间:2022年1月
影响因子:17.5
研究背景
结直肠癌(Colorectal cancer, CRC)是全球范围内最常见的癌症之一,结直肠癌的发生发展不仅受遗传和表观遗传调控,而且与肿瘤微环境(TME)特别是肿瘤免疫微环境密切相关。
巨噬细胞是TME中最丰富的免疫细胞类型之一,它们被称为肿瘤相关巨噬细胞(TAMs)。之前研究发现,TAMs表达的PD-1可抑制吞噬和抗肿瘤免疫,而TAMs来源的CCL5可通过p65/STAT3-CSN5-PD-L1通路促进CRC细胞的免疫逃逸,这些研究提示TAMs可抑制局部免疫,促进肿瘤免疫逃逸和进展,TAMs可能是肿瘤免疫治疗的一个潜在靶点。然而,TAMs如何在CRC TME中接受改造仍然存在许多未知。
小细胞外囊泡(sEVs)是细胞分泌的直径为30 ~ 150 nm的细胞外囊泡,是细胞间信号传导的重要调控因子和有前景的生物标志物。sEVs携带复杂的生物分子,包括蛋白质、脂质、DNA和RNA。在这些货物中,microRNAs (miRNAs)被认为是最重要的信号分子之一。作者的研究和许多其它研究证实了在TME中,sEVs介导的功能性miRNA传递在细胞间通讯中起着关键作用。
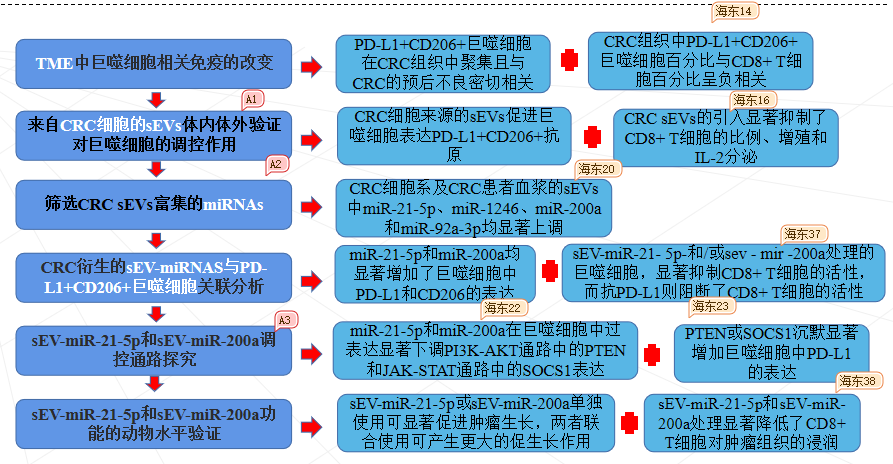
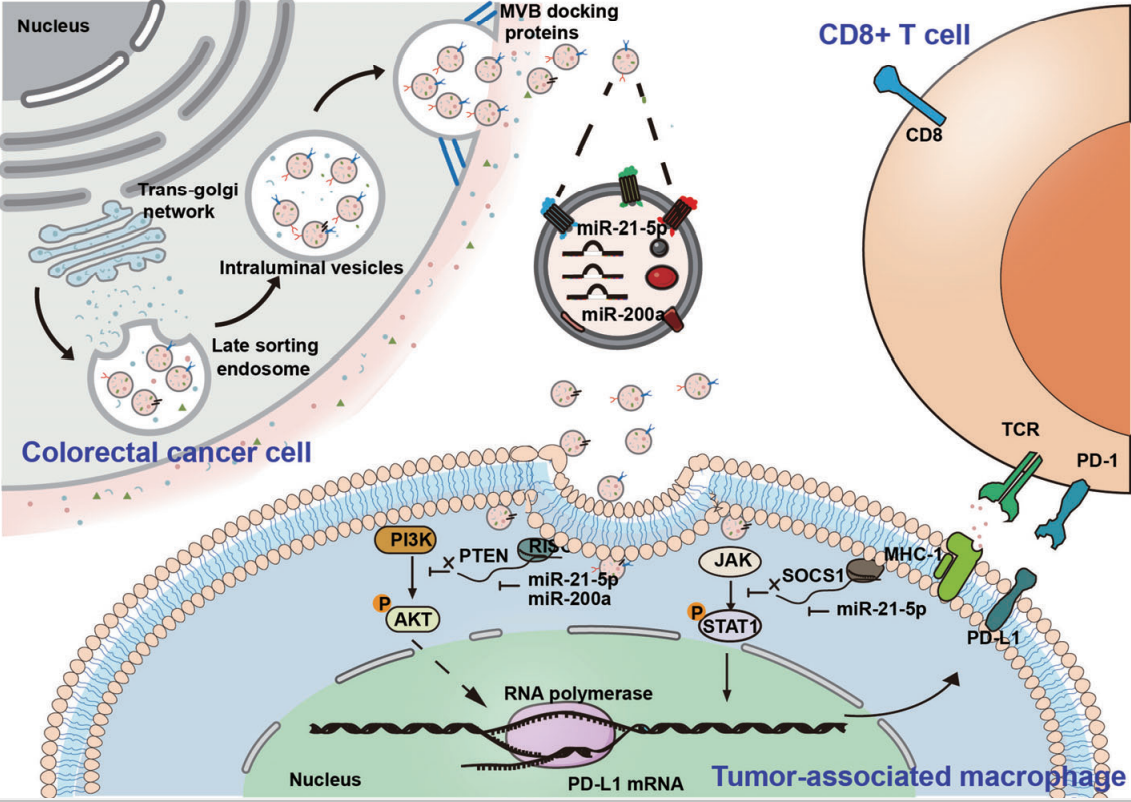
在本研究中,作者观察到CRC细胞中PD-L1水平很低,而TAMs中PD-L1水平很高,并鉴定了一个PD-L1+CD206+巨噬细胞亚群,该亚群在巨噬细胞浸润过程中被肿瘤细胞诱导,与结肠癌的不良预后相关。详细的机制研究发现,CRC衍生的sEV-miR-21-5p和sEV-miR-200a协同诱导TAM中巨噬细胞向M2极化,并通过PTEN/AKT和SOCS1/STAT1信号通路表达PD-L1,促进TAM介导的CD8+T淋巴细胞抑制,从而促进免疫逃逸和CRC进展。
研究思路
关键技术和创新
关键技术:
(1)单细胞测序
(2)免疫细胞共培养
(3)小细胞外囊泡荧光示踪
(4)免疫组化与免疫荧光
(5)免疫流式
创新点:
(1)研究深入:从PD-L1+CD206+巨噬细胞在CRC微环境中聚集这一现象出发,深入探究它与肿瘤免疫逃逸的关系和产生免疫逃逸的通路机制,所使用的研究手段也十分全面;
(2)紧跟热点:将肿瘤微环境这一影响肿瘤发生发展的新方面作为自己的研究重点,把肿瘤细胞、巨噬细胞和T细胞三者在微环境中的关系讲解得十分清晰。
文献案例
英文标题:Colorectal Cancer-Derived Small Extracellular Vesicles Promote Tumor Immune Evasion by Upregulating PD-L1 Expression in Tumor-Associated Macrophages
期刊:Advanced Science
发表时间:2022年1月
影响因子:17.5
研究背景
结直肠癌(Colorectal cancer, CRC)是全球范围内最常见的癌症之一,结直肠癌的发生发展不仅受遗传和表观遗传调控,而且与肿瘤微环境(TME)特别是肿瘤免疫微环境密切相关。
巨噬细胞是TME中最丰富的免疫细胞类型之一,它们被称为肿瘤相关巨噬细胞(TAMs)。之前研究发现,TAMs表达的PD-1可抑制吞噬和抗肿瘤免疫,而TAMs来源的CCL5可通过p65/STAT3-CSN5-PD-L1通路促进CRC细胞的免疫逃逸,这些研究提示TAMs可抑制局部免疫,促进肿瘤免疫逃逸和进展,TAMs可能是肿瘤免疫治疗的一个潜在靶点。然而,TAMs如何在CRC TME中接受改造仍然存在许多未知。
小细胞外囊泡(sEVs)是细胞分泌的直径为30 ~ 150 nm的细胞外囊泡,是细胞间信号传导的重要调控因子和有前景的生物标志物。sEVs携带复杂的生物分子,包括蛋白质、脂质、DNA和RNA。在这些货物中,microRNAs (miRNAs)被认为是最重要的信号分子之一。作者的研究和许多其它研究证实了在TME中,sEVs介导的功能性miRNA传递在细胞间通讯中起着关键作用。
在本研究中,作者观察到CRC细胞中PD-L1水平很低,而TAMs中PD-L1水平很高,并鉴定了一个PD-L1+CD206+巨噬细胞亚群,该亚群在巨噬细胞浸润过程中被肿瘤细胞诱导,与结肠癌的不良预后相关。详细的机制研究发现,CRC衍生的sEV-miR-21-5p和sEV-miR-200a协同诱导TAM中巨噬细胞向M2极化,并通过PTEN/AKT和SOCS1/STAT1信号通路表达PD-L1,促进TAM介导的CD8+T淋巴细胞抑制,从而促进免疫逃逸和CRC进展。
研究思路

关键技术和创新

关键技术:
(1)单细胞测序
(2)免疫细胞共培养
(3)小细胞外囊泡荧光示踪
(4)免疫组化与免疫荧光
(5)免疫流式
创新点:
(1)研究深入:从PD-L1+CD206+巨噬细胞在CRC微环境中聚集这一现象出发,深入探究它与肿瘤免疫逃逸的关系和产生免疫逃逸的通路机制,所使用的研究手段也十分全面;
(2)紧跟热点:将肿瘤微环境这一影响肿瘤发生发展的新方面作为自己的研究重点,把肿瘤细胞、巨噬细胞和T细胞三者在微环境中的关系讲解得十分清晰。
- 上一篇:铜死亡
- 下一篇:坏死性凋亡在肿瘤放疗研究中应用



