乳酸化驱动METTL3介导的RNA m6A修饰促进肿瘤浸润髓样细胞的免疫抑制
发布日期:2023-04-28 浏览次数:1403
2022年3月23日,浙江大学医学院王青青教授在Molecular Cell在线发表“Lactylation-driven METTL3-mediated RNA m6A modification promotes immunosuppression of tumor-infiltrating myeloid cells”的研究论文。
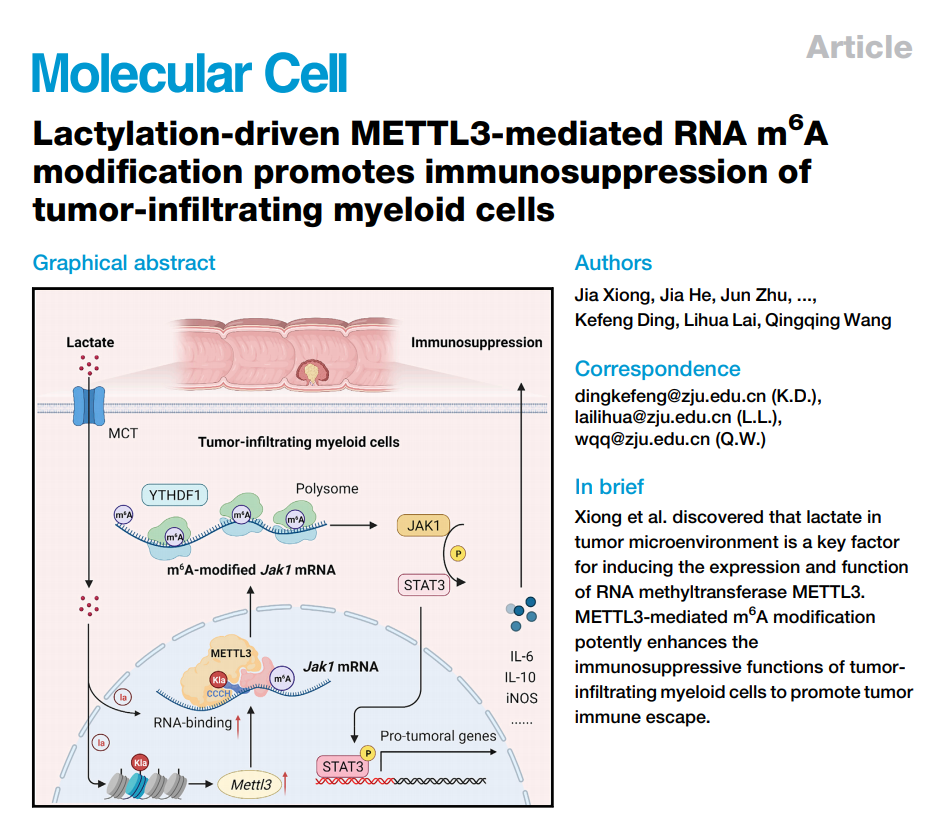
该研究发现,肿瘤微环境中积累的乳酸,以蛋白乳酸化修饰(lactylation)的形式调控RNA甲基转移酶METTL3介导的肿瘤浸润髓系细胞(tumor-infiltrating myeloid cells, TIMs)的N6-甲基腺嘌呤(N6-methyladenosine,m6A)修饰,促进TIMs的免疫抑制功能,从而介导肿瘤的免疫逃逸。
背景
肿瘤浸润髓系细胞主要包括肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)、髓系来源抑制性细胞(myeloid-derived suppressor cells, MDSCs)、肿瘤相关中性粒细胞(tumor-associated neutrophils, TANs)等,在免疫抑制性微环境的形成和维持中发挥关键作用。目前,多种靶向或改造TIMs的免疫治疗药物已进入临床试验。
该研究围绕肿瘤炎性微环境中髓系细胞的功能调控机制开展研究,鉴定了数个调控MDSCs或TAMs功能的重要信号通路,包括TGF-β/miR-494/PTEN, IL-27/WSX-1, IL-33/ST2, FBXW7/c-Myc等,以期为阐明肿瘤免疫逃逸机制提供新的认识。
RNA的m6A修饰主要由甲基转移酶复合体(methyltransferase complex, MTC)进行催化,MTC中METTL3是具有催化活性的关键蛋白。METTL3在多种类型的肿瘤细胞中被证实发挥促癌作用,但在调控TIMs功能中的作用仍不清晰。
该研究结果表明,肿瘤微环境中的乳酸是诱导RNA甲基转移酶METTL3表达和发挥功能的关键因素。METTL3介导的 m6A修饰可有效增强肿瘤浸润骨髓细胞的免疫抑制功能,促进肿瘤免疫逃逸。
研究思路

创新之处
创新之处:
从“代谢-表观-转录”层面,揭示肿瘤微环境持续积累的乳酸如何促进METTL3表达和功能,继而以m6A修饰方式增强JAK1-STAT3枢纽信号活化,结果可能为靶向髓系细胞的肿瘤免疫治疗策略提供新的启示。
2022年3月23日,浙江大学医学院王青青教授在Molecular Cell在线发表“Lactylation-driven METTL3-mediated RNA m6A modification promotes immunosuppression of tumor-infiltrating myeloid cells”的研究论文。
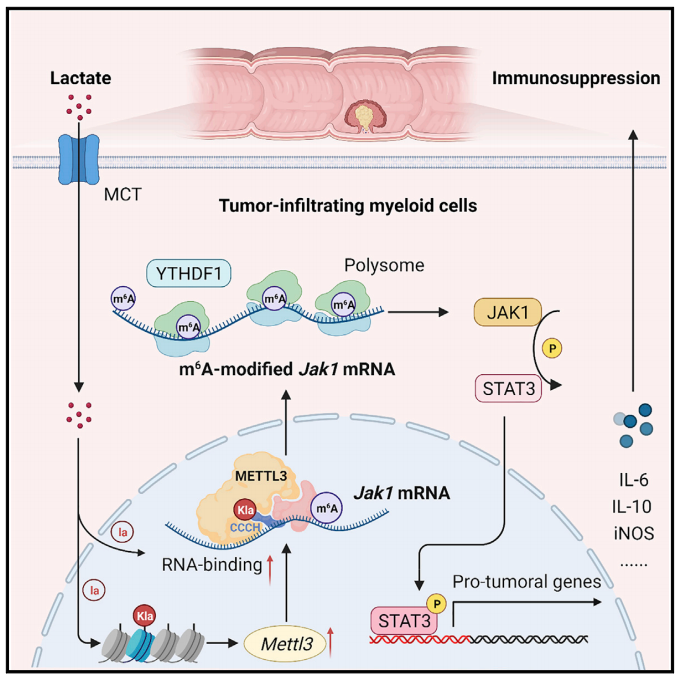
该研究发现,肿瘤微环境中积累的乳酸,以蛋白乳酸化修饰(lactylation)的形式调控RNA甲基转移酶METTL3介导的肿瘤浸润髓系细胞(tumor-infiltrating myeloid cells, TIMs)的N6-甲基腺嘌呤(N6-methyladenosine,m6A)修饰,促进TIMs的免疫抑制功能,从而介导肿瘤的免疫逃逸。

背景
肿瘤浸润髓系细胞主要包括肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)、髓系来源抑制性细胞(myeloid-derived suppressor cells, MDSCs)、肿瘤相关中性粒细胞(tumor-associated neutrophils, TANs)等,在免疫抑制性微环境的形成和维持中发挥关键作用。目前,多种靶向或改造TIMs的免疫治疗药物已进入临床试验。
该研究围绕肿瘤炎性微环境中髓系细胞的功能调控机制开展研究,鉴定了数个调控MDSCs或TAMs功能的重要信号通路,包括TGF-β/miR-494/PTEN, IL-27/WSX-1, IL-33/ST2, FBXW7/c-Myc等,以期为阐明肿瘤免疫逃逸机制提供新的认识。
RNA的m6A修饰主要由甲基转移酶复合体(methyltransferase complex, MTC)进行催化,MTC中METTL3是具有催化活性的关键蛋白。METTL3在多种类型的肿瘤细胞中被证实发挥促癌作用,但在调控TIMs功能中的作用仍不清晰。
该研究结果表明,肿瘤微环境中的乳酸是诱导RNA甲基转移酶METTL3表达和发挥功能的关键因素。METTL3介导的 m6A修饰可有效增强肿瘤浸润骨髓细胞的免疫抑制功能,促进肿瘤免疫逃逸。
研究思路

创新之处

创新之处:
从“代谢-表观-转录”层面,揭示肿瘤微环境持续积累的乳酸如何促进METTL3表达和功能,继而以m6A修饰方式增强JAK1-STAT3枢纽信号活化,结果可能为靶向髓系细胞的肿瘤免疫治疗策略提供新的启示。



