缺氧诱导的 circWSB1 通过与 USP10 相互作用破坏 p53 促进乳腺癌进展
发布日期:2023-08-16 浏览次数:1612
文献介绍
题目: Hypoxia-induced circWSB1 promotes breast cancer progression through destabilizing p53 by interacting with USP10
发表时间:2022 年 5 月 29 日
期刊:Molecular Cancer
影响因子:41.4

引言
乳腺癌(Breast cancer,BC)是全世界女性中最常见的恶性肿瘤,约占所有癌症病例的 30%,占女性所有癌症死亡人数的 15%。尽管过去几十年在早期诊断、手术、放化疗、内分泌治疗和靶向治疗等方面取得了很大进展,但 BC 仍然是全球 100 多个国家女性癌症死亡的主要原因。因此,迫切需要寻找新的生物标志物和治疗靶点来诊断和治疗 BC。
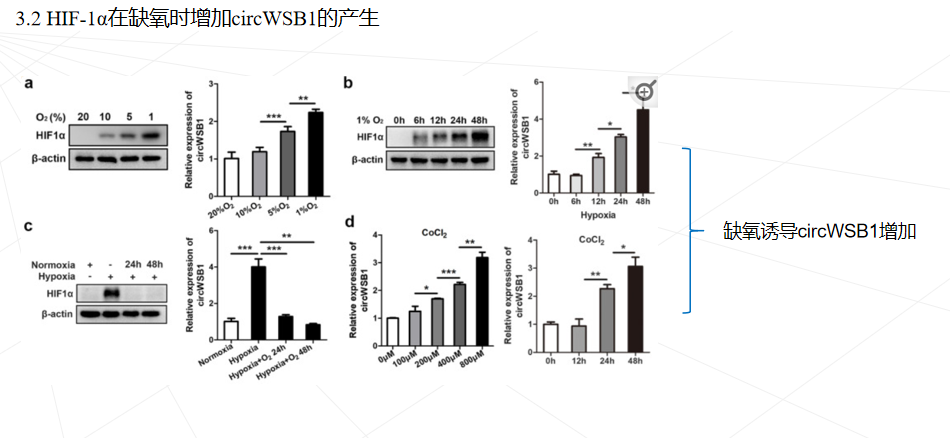
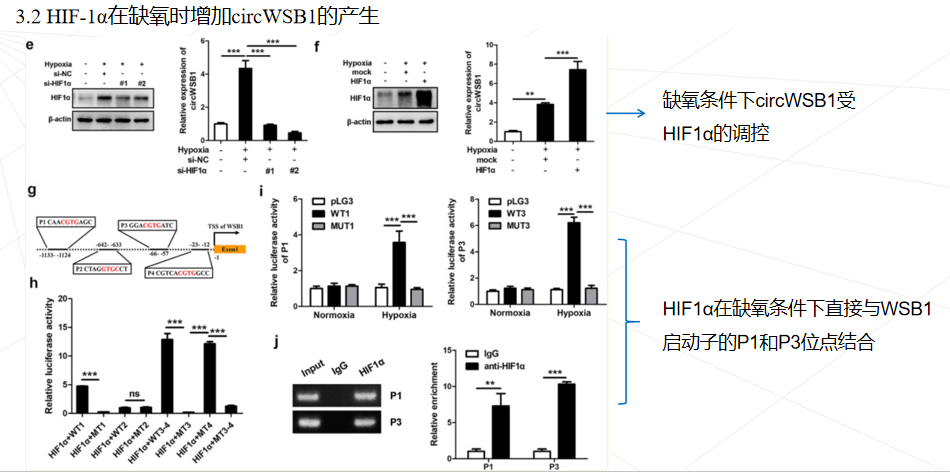
低氧常见于 BC 以及许多其他实体瘤,这通常是由于肿瘤细胞过度增殖和肿瘤血管系统异常紊乱造成的。缺氧诱导因子 1 (HIF1)是细胞对缺氧反应的中心调节因子。HIF1 通过与其启动子区域内的缺氧反应元件 (HRE) 结合来激活多种基因的转录,以帮助癌细胞适应缺氧条件,从而导致癌细胞更具侵袭性和转移性表型。在 BC 中观察到 HIF1α 表达增加,高水平的 HIF1α 是 BC 患者死亡率的独立预测因子。然而,HIF1 介导的 BC 缺氧反应的分子机制仍不完全清楚。
研究表明,circRNA 参与了许多人类疾病的病理过程,尤其是癌症。据报道,几种 circRNA 与缺氧密切相关,并在癌症进展中起关键作用。例如,circDENND4C 在乳腺癌中过度表达,其表达是由缺氧诱导的。敲低 circDENND4C 可通过上调 miR-200b/c 在缺氧条件下抑制 BC 细胞的迁移、侵袭和糖酵解 。然而,在缺氧条件下,大多数 circRNA 在癌症中的生物发生和生物学功能仍然很大程度上未知。
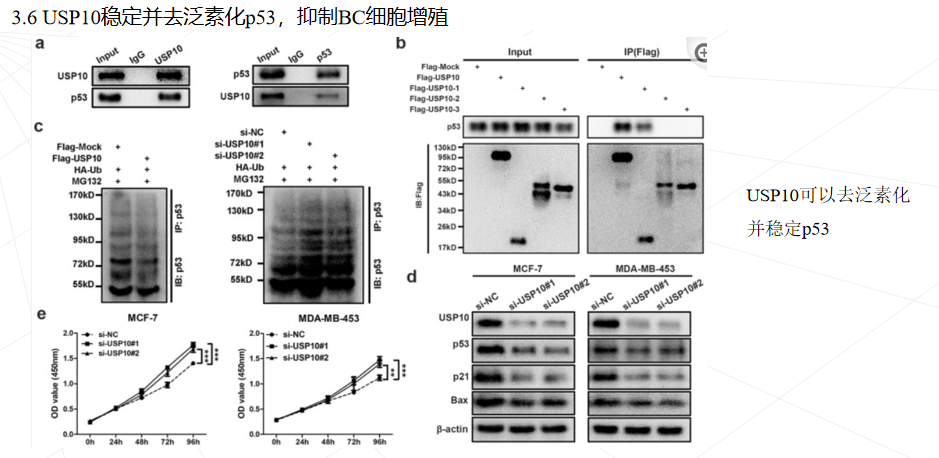
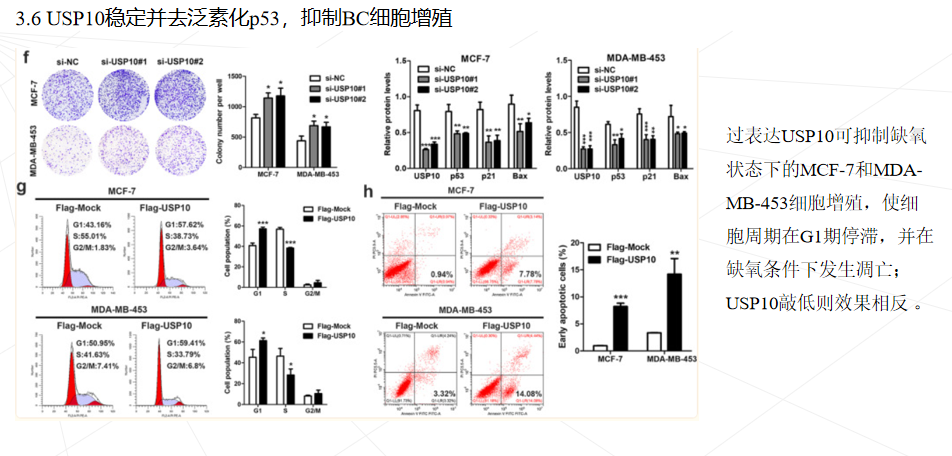
p53是与人类肿瘤相关性最高的肿瘤抑制因子。p53信号通路失活在BC的发病机制中起重要作用。大约 75% 的 BC 患者是野生型 p53。除了基因缺失和点突变,蛋白质的异常翻译后修饰已被证明是 p53 失活的另一种机制。p53活性和稳定性的调节主要通过磷酸化、泛素化和乙酰化等翻译后修饰来进行。MDM2 E3泛素连接酶介导的p53泛素化诱导p53降解并在p53调控中起主要作用,而一些去泛素酶(DUBs)可以逆转p53的泛素化并稳定其蛋白水平。去泛素化酶 USP10 可以去泛素化和稳定 p53,并抑制 MDM2 介导的 p53 泛素化和降解。此外,另一种去泛素化酶 USP7 也已被证明可以去泛素化并强烈稳定 p53。然而,其它的p53 调控机制及其在 BC 发病机制中的作用仍然未知。
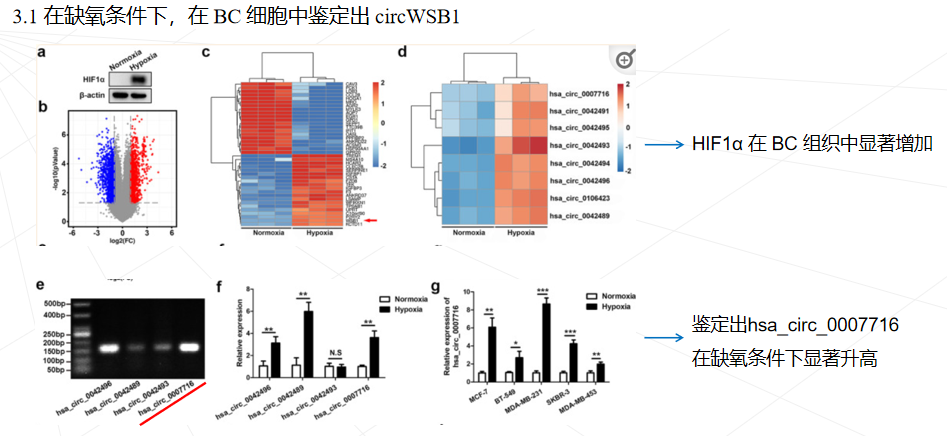
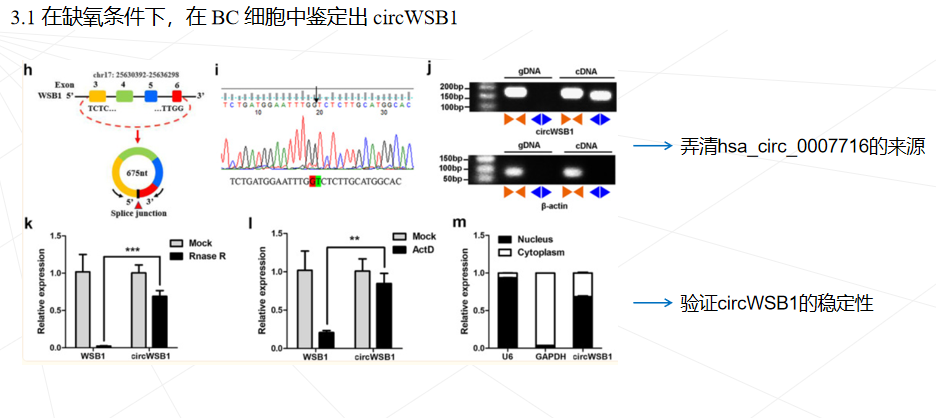
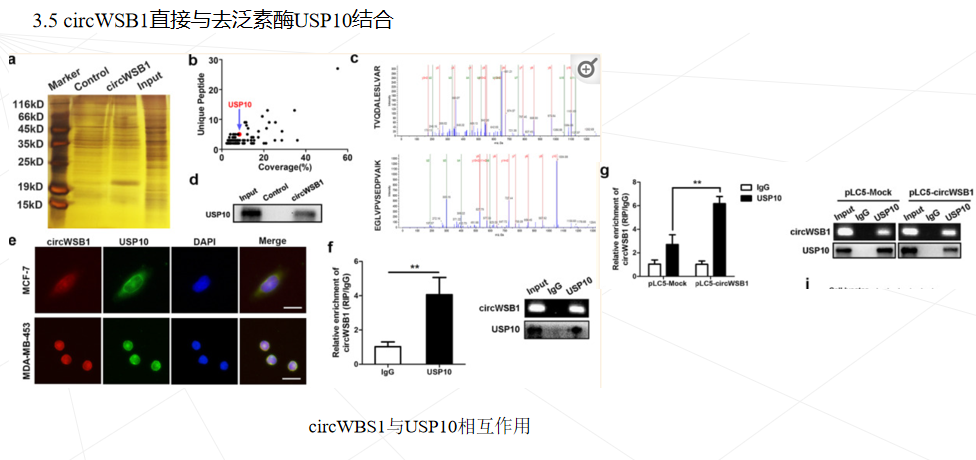
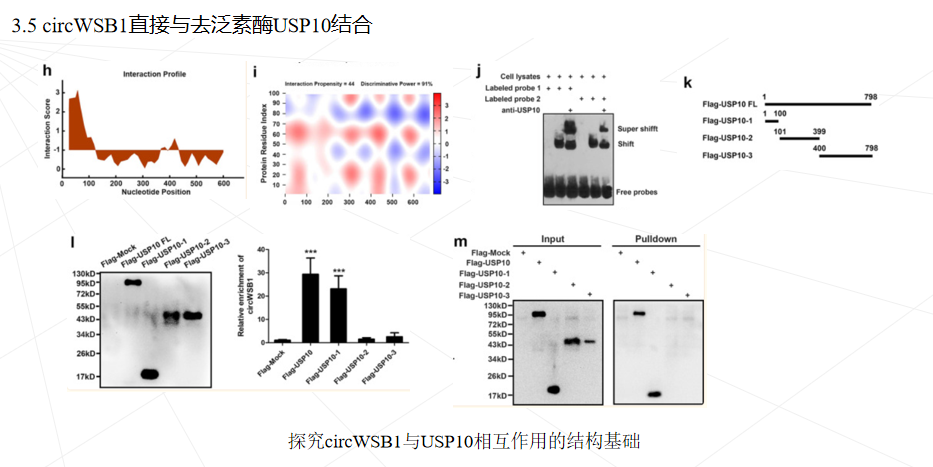
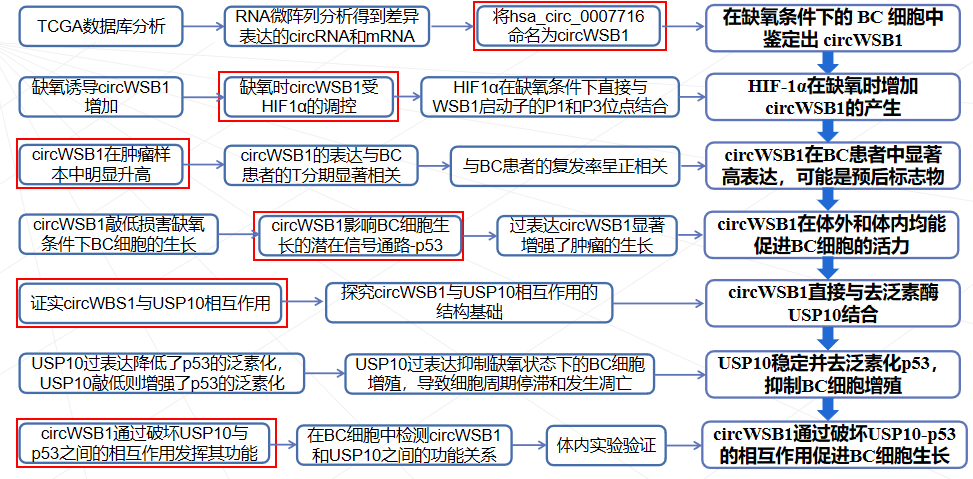
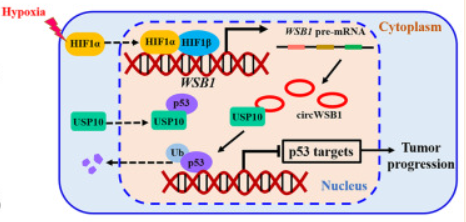
本研究鉴定了一种源自 WSB1 外显子 3、4、5 和 6 的新型circWSB1基因在BC组织中表达上调,与BC患者的不良临床预后密切相关。发现circWSB1在缺氧条件下被HIF1α转录上调,并在体内和体外促进BC细胞的增殖。机制研究表明,circWSB1可以直接与去泛素酶USP10结合,减弱USP10介导的p53稳定化,导致p53降解和BC进展。本研究结果为缺氧诱导的 circWSB1 如何促进 BC 进展的潜在分子机制提供了新的见解,揭示了 circWSB1 作为 BC 的替代治疗靶点和预后标志物的可能性。
3、结果
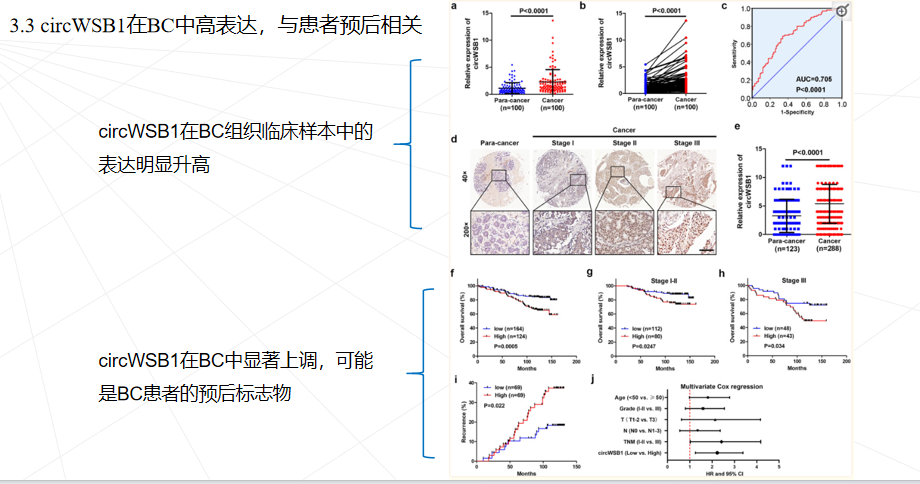
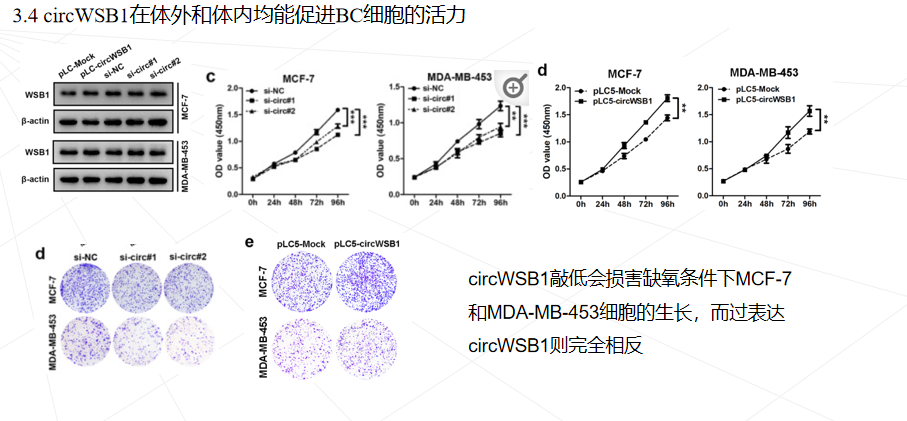
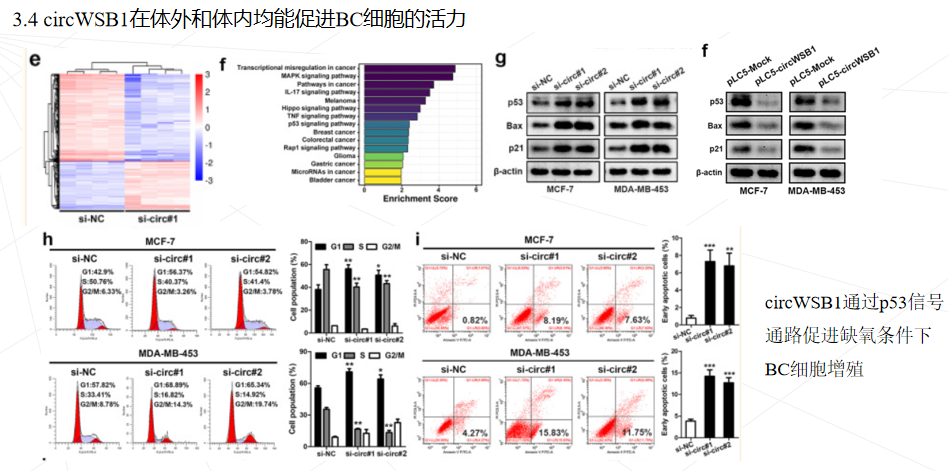
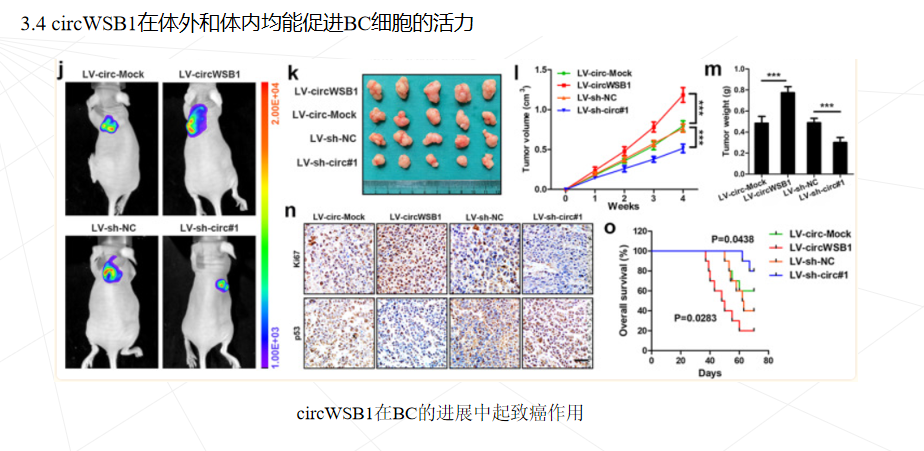
研究思路
创新之处
主要实验方法:
1. CCK-8,流式检测细胞凋亡及周期,克隆形成实验;
2. 裸鼠成瘤,活体生物发光成像;
3. 转录组测序,Sanger测序;
4. GO和KEGG 富集分析;
5. 双荧光素酶报告基因实验;
6. siRNA干扰,过表达;原位杂交,免疫组化;
7. qPCR、WB实验;
8. RIP、RNA pull down、CoIP、ChIP
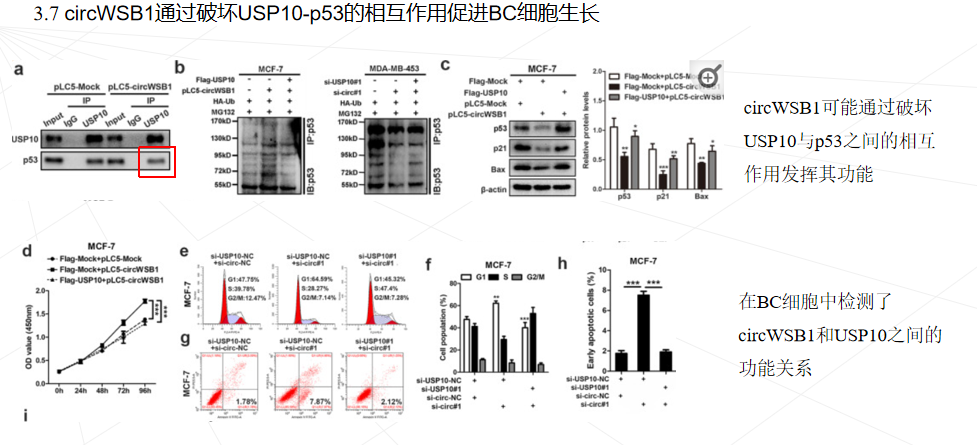
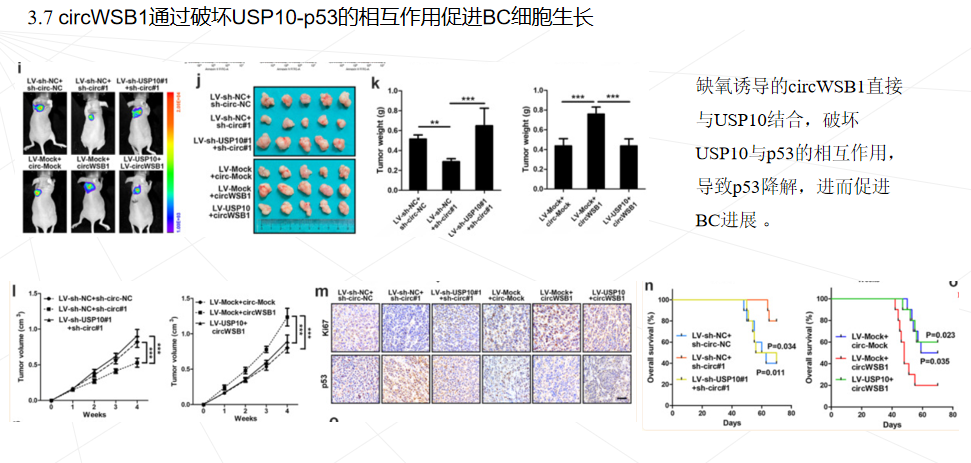
本研究首次发现circWSB1在缺氧条件下被HIF1α显著诱导,并可与USP10结合,破坏USP10与p53的相互作用,导致p53多素化并随后降解,从而帮助肿瘤细胞在缺氧条件下存活,促进BC的进展。本研究可能有助于理解缺氧如何通过circWSB1促进BC的发展,并证明circWSB1可能是BC的一个新的预后标志物和治疗靶点。
文献介绍
题目: Hypoxia-induced circWSB1 promotes breast cancer progression through destabilizing p53 by interacting with USP10
发表时间:2022 年 5 月 29 日
期刊:Molecular Cancer
影响因子:41.4

引言
乳腺癌(Breast cancer,BC)是全世界女性中最常见的恶性肿瘤,约占所有癌症病例的 30%,占女性所有癌症死亡人数的 15%。尽管过去几十年在早期诊断、手术、放化疗、内分泌治疗和靶向治疗等方面取得了很大进展,但 BC 仍然是全球 100 多个国家女性癌症死亡的主要原因。因此,迫切需要寻找新的生物标志物和治疗靶点来诊断和治疗 BC。
低氧常见于 BC 以及许多其他实体瘤,这通常是由于肿瘤细胞过度增殖和肿瘤血管系统异常紊乱造成的。缺氧诱导因子 1 (HIF1)是细胞对缺氧反应的中心调节因子。HIF1 通过与其启动子区域内的缺氧反应元件 (HRE) 结合来激活多种基因的转录,以帮助癌细胞适应缺氧条件,从而导致癌细胞更具侵袭性和转移性表型。在 BC 中观察到 HIF1α 表达增加,高水平的 HIF1α 是 BC 患者死亡率的独立预测因子。然而,HIF1 介导的 BC 缺氧反应的分子机制仍不完全清楚。
研究表明,circRNA 参与了许多人类疾病的病理过程,尤其是癌症。据报道,几种 circRNA 与缺氧密切相关,并在癌症进展中起关键作用。例如,circDENND4C 在乳腺癌中过度表达,其表达是由缺氧诱导的。敲低 circDENND4C 可通过上调 miR-200b/c 在缺氧条件下抑制 BC 细胞的迁移、侵袭和糖酵解 。然而,在缺氧条件下,大多数 circRNA 在癌症中的生物发生和生物学功能仍然很大程度上未知。
p53是与人类肿瘤相关性最高的肿瘤抑制因子。p53信号通路失活在BC的发病机制中起重要作用。大约 75% 的 BC 患者是野生型 p53。除了基因缺失和点突变,蛋白质的异常翻译后修饰已被证明是 p53 失活的另一种机制。p53活性和稳定性的调节主要通过磷酸化、泛素化和乙酰化等翻译后修饰来进行。MDM2 E3泛素连接酶介导的p53泛素化诱导p53降解并在p53调控中起主要作用,而一些去泛素酶(DUBs)可以逆转p53的泛素化并稳定其蛋白水平。去泛素化酶 USP10 可以去泛素化和稳定 p53,并抑制 MDM2 介导的 p53 泛素化和降解。此外,另一种去泛素化酶 USP7 也已被证明可以去泛素化并强烈稳定 p53。然而,其它的p53 调控机制及其在 BC 发病机制中的作用仍然未知。
本研究鉴定了一种源自 WSB1 外显子 3、4、5 和 6 的新型circWSB1基因在BC组织中表达上调,与BC患者的不良临床预后密切相关。发现circWSB1在缺氧条件下被HIF1α转录上调,并在体内和体外促进BC细胞的增殖。机制研究表明,circWSB1可以直接与去泛素酶USP10结合,减弱USP10介导的p53稳定化,导致p53降解和BC进展。本研究结果为缺氧诱导的 circWSB1 如何促进 BC 进展的潜在分子机制提供了新的见解,揭示了 circWSB1 作为 BC 的替代治疗靶点和预后标志物的可能性。
3、结果














研究思路

创新之处

主要实验方法:
1. CCK-8,流式检测细胞凋亡及周期,克隆形成实验;
2. 裸鼠成瘤,活体生物发光成像;
3. 转录组测序,Sanger测序;
4. GO和KEGG 富集分析;
5. 双荧光素酶报告基因实验;
6. siRNA干扰,过表达;原位杂交,免疫组化;
7. qPCR、WB实验;
8. RIP、RNA pull down、CoIP、ChIP
本研究首次发现circWSB1在缺氧条件下被HIF1α显著诱导,并可与USP10结合,破坏USP10与p53的相互作用,导致p53多素化并随后降解,从而帮助肿瘤细胞在缺氧条件下存活,促进BC的进展。本研究可能有助于理解缺氧如何通过circWSB1促进BC的发展,并证明circWSB1可能是BC的一个新的预后标志物和治疗靶点。



